MAH小灵通开始广播了。这次分享一下MAH制度下,北京25年第一季度二类医疗器械注册新趋势。
下面是对今年第一季度北京药监局颁发的MAH制度下二类证的详细分析。
一、数据概览与整体情况
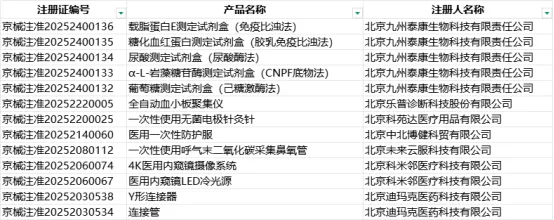
根据北京市药品监督管理局2025年1-3月发布的医疗器械注册数据,共新增13个第二类医疗器械注册证,涉及7家注册人企业。
二、产品类型分布
IVD试剂5项,占比最高(38.5%),主要涉及血糖、尿酸、载脂蛋白等检测试剂盒。
设备类3项,包含内窥镜摄像系统、冷光源及血小板聚集仪。
耗材3项,以防护服、针灸针、鼻氧管为主。
无源器械2项,为连接器、连接管等手术辅助工具。
三、受托生产企业信息分析
主要受托企业:
北京华大吉比爱生物技术有限公司(IVD试剂委托生产,共5条)。
烟台艾德康生物科技有限公司(全自动血小板聚集仪)。
江苏宏鑫医疗科技有限公司(鼻氧管)。
生产地址分布:
北京本地为主(顺义、昌平)、山东烟台、河北张家口、河南林州、江苏沭阳等。
注册人集中度:
北京九州泰康生物科技有限责任公司(IVD试剂,5条)。
北京科米邻医疗科技有限公司(内窥镜设备,2条)。
北京迪玛克医药科技有限公司(无源器械,2条)。
四、典型案例分析
行业特点:
北京医疗器械产业以IVD试剂和 医疗设备为主导,依托本地生物科技企业(如九州泰康)和技术服务公司(如科米邻)。
委托生产模式普遍,尤其试剂类多委托外省企业生产(如河北、山东)。
2025年北京第二类医疗器械受托生产以IVD试剂为核心,依托多地协作生产。注:数据统计周期为2025年1月1日-3月31日

了解器械MAH制度,必须关注MAH小灵通,从此不再走弯路,不被忽悠。